12. prosince 2024
Vědci z CEITEC Masarykovy univerzity (MUNI) učinili objev, který může mít velký význam pro léčbu nemocí, jako jsou Alzheimerova choroba, ALS nebo rakovina. Jejich studie se zaměřuje na to, jak buňky udržují dynamickou rovnováhu mezi různými stavy proteinů, aby proteiny mohly správně fungovat. Tento objev otevírá cestu k vývoji nových terapeutických přístupů u onemocnění spojených s poruchami proteinů.
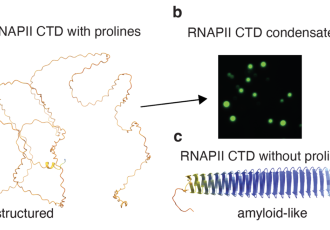
Aby proteiny, molekuly klíčové pro všechny životní funkce, mohly v buňkách správně plnit svou roli, nabývají různých fyzikálních stavů od tekutých až po pevné formy. Často se vyskytují také v mezistavech, které vynikají procesem zvaným fázová separace, v nichž se sdružují do kapkovitých struktur a kterým vědci říkají kondenzáty. Tyto kapky jim umožňují vzájemně dynamicky a účinně spolupracovat, což je nezbytné pro správné fungování buněk. Když však dojde k narušení této křehké rovnováhy, mohou proteiny „ztuhnout“ do struktury podobné amyloidům, které jsou spojovány s neurodegenerativními onemocněními jako např. amyotrofickou laterální sklerózou (ALS) nebo Alzheimerovou chorobou.
Ve své studii publikované v prestižním časopise Nature Communications se vědci zaměřili na enzym RNA polymeráza II, který hraje zásadní roli při čtení a přepisování genetických informací v našich buňkách. Výzkumný tým pod vedením Richarda Štefla a Roberta Váchy z CEITEC MUNI kombinací experimentálních technik s počítačovým modelováním zjistil, že tento enzym obsahuje oblast bohatou na aminokyselinu prolin, která je klíčová pro vytváření kapkovitých kondenzátů a zabraňuje tuhnutí RNA polymerázy II do škodlivých agregátů. Tato schopnost enzymu tvořit kondenzáty je klíčová, protože mu umožňuje efektivně provádět genovou transkripci.
Podstatné však bylo zjištění, že na přechod RNA polymerázy II mezi jednotlivými materiálovými stavy má významný vliv fosforylace, tj. proces, při kterém buňka přidává k enzymu malou chemickou skupinu (fosfát) a díky kterému ovlivňuje fungování enzymů. „Pozorovali jsme, že když se RNA polymeráza II a další molekuly seskupí do malých kapkovitých struktur, celý proces fosforylace se několikanásobně zrychlí. To znamená, že tyto kapky akcelerují v buňce důležité biochemické reakce, které enzym potřebuje k tomu, aby správně fungoval,“ říká Kateřina Linhartová, hlavní autorka studie. „Tento objev může pomoci vědcům pochopit, proč dochází ke škodlivému tuhnutí proteinů, které je dáváno do souvislosti s neurodegenerativními nemocemi. Pokud se vědci naučí tento proces kontrolovat, mohli by vyvinout nové léčebné přístupy, které by zabránily vzniku těchto nemocí nebo dokonce zvrátila jejich progresi,“ doplňuje Richard Štefl, vedoucí výzkumného týmu.
Biomolekulární kondenzáty, kdysi poměrně přehlížený fenomén, si nyní získávají pozornost farmaceutického průmyslu. S tím, jak se vědci hlouběji zabývají vlivem fázové separace na buněčné funkce, se rozšiřuje potenciál využití těchto poznatků v enzymovém inženýrství a vývoji léčiv.


 Sdílet
Sdílet