4. května 2021
Tisková zpráva;
„Viry, tvorové na hranici živých a neživých organismů, oplývají ďábelskou genialitou, která mě nikdy nepřestane udivovat,“ říká Dominik Hrebík, první autor nedávno publikované studie, která odhaluje překvapivé chování rhinovirů. Dominik Hrebík, doktorand z výzkumné skupiny Pavla Plevky, studuje trojrozměrné struktury virů pomocí kryo-elektronové mikroskopie. Tato technologie mu pomohla popsat, jak rhinoviry infikují lidské buňky. Jeho zjištění vyvrátila současnou hypotézu propojující nízké pH s vypuštěním genomu viru v buňce. Jeho studie byla publikována v květnovém vydání odborného časopisu Proceedings of the National Academy of Sciences of the United States of America (PNAS).

Rhinoviry patří mezi nejčastější příčiny infekcí, se kterými se lidstvo potýká. Způsobují běžné nachlazení a další respirační onemocnění a mohou také zhoršovat příznaky astmatu. Rhinoviry se vyskytují na celém světě a příznaky onemocnění zahrnují bolest v krku, rýmu, ucpaný nos, kýchání a kašel. Ačkoli běžné nachlazení má jen malé přímé zdravotní důsledky pro pacienty, je toto onemocnění spojeno s obrovskými náklady pro společnost v podobě zmeškaného vyučování a práce i vynaložené lékařské péče.
Při infikování člověka se rhinovirus váže na protein lidské buňky zvaný intercelulární adhezní molekula 1, zkráceně ICAM-1, a přichytí se na povrch buňky. Poté ICAM-1 vyšle do buňky signál, který způsobí, že buňka virus pohltí. Virus v buňce uvolní svůj genom a převezme kontrolu nad buňkou, aby zajistil produkci nových virových částic. Genom viru se uvolní do buňky jako voda tryskající z balónku naplněného vodou. Rhinoviry jsou tak pro lidské buňky nezvaní hosté s nepříjemným překvapením.
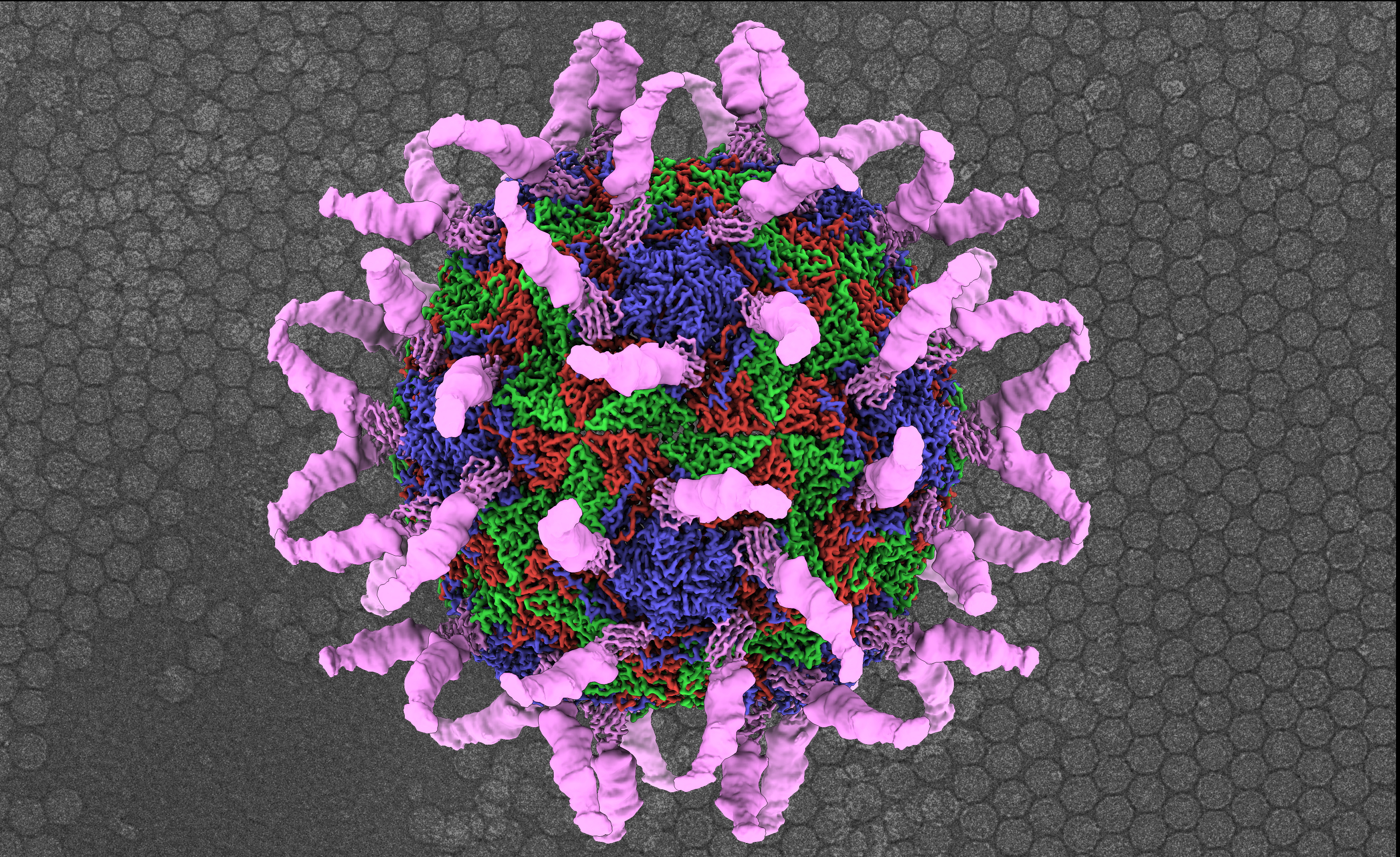
Dosud nebylo jasné, jak se virus váže na receptor a co přesně spouští uvolňování genomu. Proto se výzkumný tým rozhodl sledovat tyto události pod kryo-elektronovým mikroskopem, který by tento proces podrobně odhalil. „Všiml jsem si, že po navázání na protein ICAM-1 virus mění strukturu své proteinové skořápky a RNA genomu, což předtím ještě nikdo nevypozoroval. Jak jsme později zjistili, tento krok je zcela zásadní pro následné uvolnění genomu,“ vysvětluje Dominik Hrebík.
Předchozí stav znalostí poukazoval na to, že nízké pH způsobuje uvolňování genomu uvnitř buňky. Výzkumný tým proto vystavil virus kyselému pH. Nic se však nestalo. Virus vůbec nereagoval. Proto vědci dospěli k závěru, že k vyvolání uvolňování genomu je zapotřebí něco jiného.
„Při pohledu na strukturu komplexu virových receptorů jsem navrhl mechanismus, kde ICAM-1 v kombinaci s kyselým pH vyvolává uvolňování RNA z viru. Abych potvrdil svou hypotézu, zkusil jsem další experiment, kde jsem vytvořil komplex viru a receptorů, který byl následně vystaven kyselému pH. Když jsem dal vzorek do kryo-elektronového mikroskopu, okamžitě jsem viděl, že téměř všechny viry uvolnily svůj genom,“ vysvětluje první autor studie Dominik Hrebík. Experimenty prováděné výzkumným týmem ověřily Hrebíkovu teorii, že receptor hraje klíčovou roli při iniciaci uvolňování genomu – což je skutečnost, která byla doposud neznámá. Tento objev by mohl vést k novým antivirovým terapiím založeným na principu blokování tvorby komplexu viru s receptory nebo blokování uvolňování genomu uvnitř buňky.
Autorka


 Sdílet
Sdílet